
2019年のノーベル賞週間も終わり、科学界も少し落ち着いてきました。
今回はノーベル医学生理学賞を受賞した「細胞の低酸素応答の解明」について、もう少し深掘りしてみようと思います。
ノーベル賞に関しての速報記事は軽く触れたものが多く、深掘りされている記事が少ないように思います。
その理由としては、ノーベル医学生理学賞は基礎研究に対して贈られることが多いので
- 私たちの実生活と関わりが薄い
- 細かすぎて良くわからない
- 科学の専門用語がたくさん出てくる
が挙げられて、一般の人からはわかりにくいのが難点です。
でもノーベル賞級の研究の背景を知ることは、科学を志す上でとても重要なのではないかと思っています。その理由としては、
- 一流の研究思考過程を追体験できる
- 一般的に行われている研究の手順を知ることができる
- どんなに小さくて細かいこと(世の中に必要なさそうなこと)でも研究として成り立つ
今年ノーベル賞を受賞した3氏の研究の歴史を紐解くことで、一流の研究思考を追体験してみようと思います。
まず第一弾として、「低酸素応答因子(HIF:Hypoxia Inducible Factor)の発見とその性質の解明」までの話をご紹介します。
主に、クレッグ・セメンザの1980年代後半から1990年代前半までの仕事の内容です。
基礎科学研究ということもあり、専門用語もたくさん出てきます。
大学で生命科学を専攻している人にわかるように書きました。
![]()
受賞理由と、私たちの生活にどう関わるのかはこちらの記事をご覧ください。
受賞した人がどんな背景を持っているのかを解説した記事もあります。
まずは酸素と生命との関わりから

酸素は生きていくのに不可欠!
酸素の発見は1777年にまで遡ります。
空気中に1/4くらいある燃焼性の物質(fire air)としてスウェーデンの研究者によって報告され、アントワーヌ・ラボアジェ(Antoine Lavoisier)によって「酸素(oxygen)」という名前が命名されました。
1858年にルイス・パスツール(Louis Pasteur)によって、動物はエネルギーを変換するために酸素を利用した様々な経路を持っていることを報告しています。(論文のタイトルは「アルコール発行の歴史に関する新しい真実」)
酸素と生命の関わりにはノーベル賞が出ている!
生物と酸素に関しては2つのノーベル賞が出ています。
- 1931年 Otto Warburg 「細胞の呼吸に酸素が必要であることの研究」
- 1938年 Corneille Heymans 「酸素に対する呼吸反応における神経システムの役割」
80年前から、生命活動に酸素が重要なのはわかっていました。
しかし、酸素濃度の変化がどのように遺伝子発現のレベルを変化させているのか基礎的なところが長い間わかっていませんでした。
エリスロポエチンの発見(低酸素状態で分泌されるホルモン)

私たちが普通に生活していたら、酸素の濃度が変わることはあまりありません。
でも高い山に行ってみたらどうでしょう?
1882年、人が高所に暮らしていたりすると酸素を全身に運ぶ役割を持っている赤血球が増えることをフランスの医者ポール・バートが実証しました。
これは低酸素状態における心血管の作用を最初に示した実験で、この実験がなければ今回のノーベル賞はありえなかったでしょう。
また、高所に行くと腎臓からエリスロポエチン(EPO)というホルモンが分泌されていることもわかりました。
その当時は高い所へ行くと、「赤血球の数が増える」と「腎臓からエリスロポエチンが分泌される」の因果関係は全くわかっていませんでした。
エリスロポエチンからHIFの発見
1980年代に様々なエリスロポエチンに関する研究がなされる中で、今回のノーベル賞受賞研究の原点となる研究が1986年に報告されます。
『低酸素状態で腎臓でのエリスロポエチンの転写発現が増える』(Maurice BondurantとMark Kouryら)
つまり、「低酸素」が刺激になって遺伝子の発現レベルでエリスロポエチンの量が制御されているということがわかったのです。
何がエリスロポエチンを遺伝子レベルで制御しているのか?
次の疑問は、「何がDNAの上で調節しているのか?」。
この問題に取り組んだのがグレッグ・セメンザ(Gregg Semenza)です。
セメンザはヒトのEPO遺伝子のDNAのサイズを色々変えたトランスジェニックマウスを作って、エリスロポエチン遺伝子のどこの部分が転写制御を受けているのかを明らかにしました。
このトランスジェニックマウスを使って、エリスロポエチンの血中レベルが上がると、血液中の赤血球の数も増えることも報告しました(Semenza et al., 1989)。
![]()
1991年に、セメンザとラトクリフはHIF発見に至るための重要な報告をします(Beck et al.,1991, Pugh et al., 1991)。
- エリスロポエチンの遺伝子上に核内因子が結合できるようになっていること
- その領域は低酸素状態になると一過的に転写が促進されること
- 腎臓だけではなくて肝臓の細胞でも同じ現象がみられること
エリスロポエチン遺伝子結合する因子の特定(HIFの命名)
セメンザは、エリスロポエチン遺伝子の転写を促進(エンハンサー)する50塩基程度の領域を特定しました。
その領域は低酸素に応答して転写が促進するため、低酸素応答性領域(HRE: Hypoxia Response Element)と名付けられました。
この領域に結合する核内因子はたくさんあります。
その中で特に、低酸素状態になると量が多くなってHREに結合する核内因子を低酸素応答誘導因子(HIF:Hypoxia Inducible Factor)と名付けました。
![]()
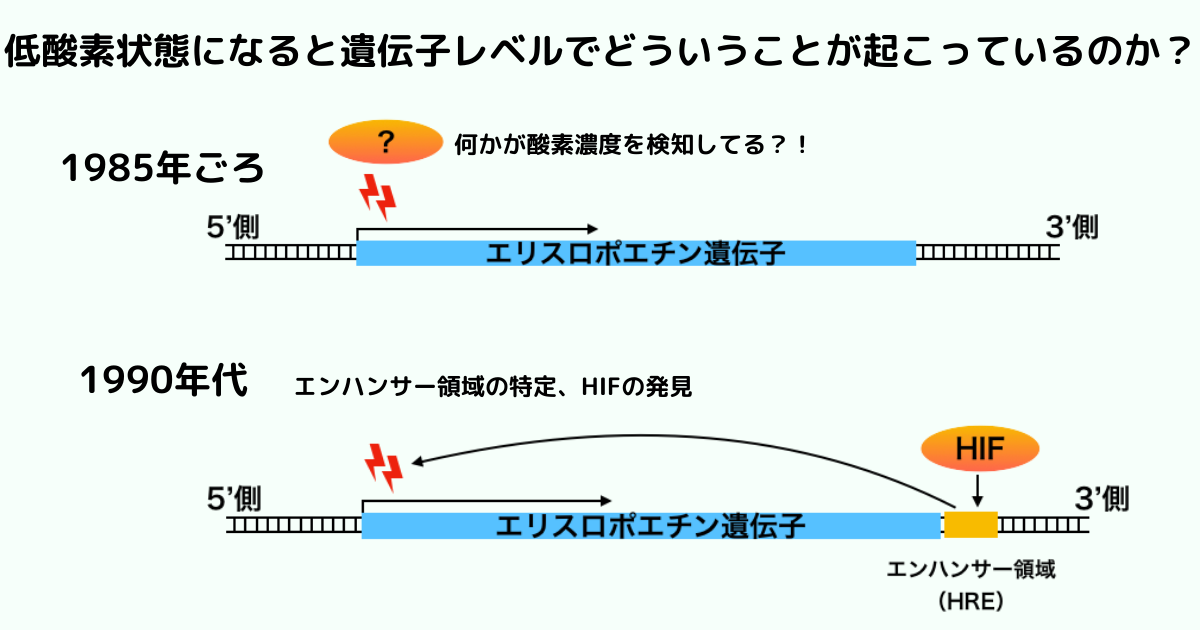
HREは腎臓や肝臓だけではなく、様々な細胞でも低酸素状態に応答して働くことがわかっていきます。
しかもヒトだけではなくて、様々な哺乳類が持っていたのです。
![]()
HIFをもっと調べてみよう
この部分は今から30年ほど前に盛んに行われた、タンパク質解析の典型のお話です。
遺伝子の発見→cDNAをクローニンング→タンパク質を精製→構造を決定→性質を解析
という流れで研究が進みます。
HIFってどんなタンパク質なの?
HIFは様々な細胞が持っている、普遍的な代謝調節に重要な分子であることがわかってきました。
セメンザは「HIF」を調べてみよう!ということでHIFタンパク質の解析を始めます。
タンパク質解析は通常このような手順で行われます。
- mRNAからcDNAをとります(逆転写→PCR)
- 取ってきたcDNAをプラスミドベクターに挿入します(制限酵素処理→ライゲーション)
- 遺伝子を入れたプラスミドを大腸菌の中に入れます(形質転換)
- 大腸菌を大量培養してたんぱく質を取ってくる
- タンパク質を精製して結晶化する
- 結晶構造解析をする
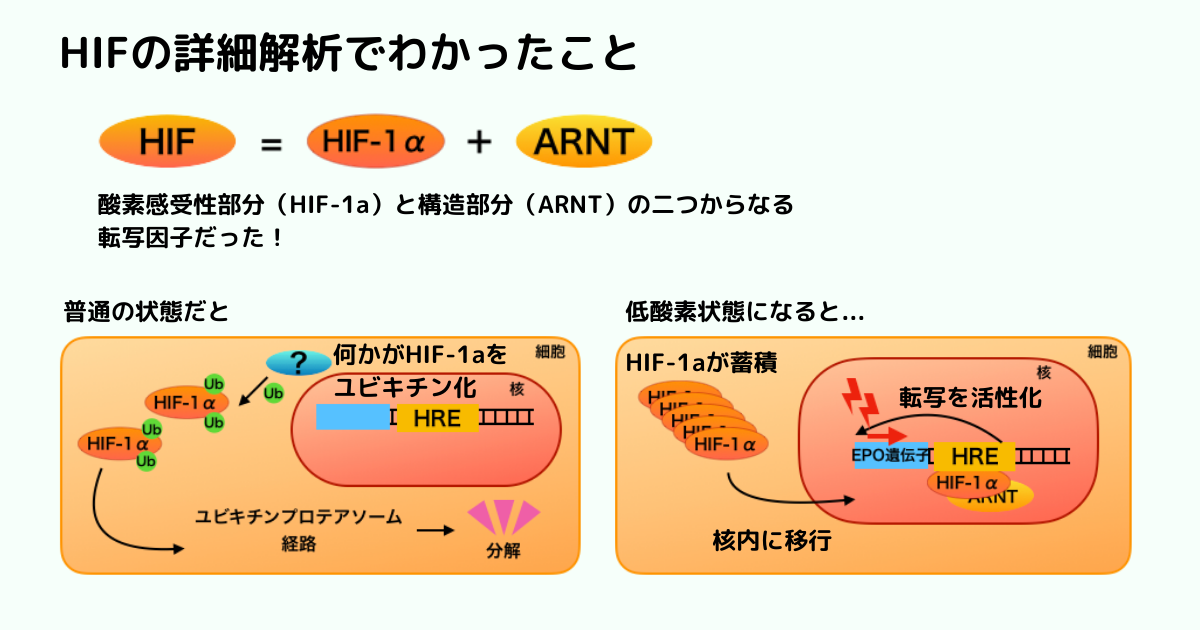
するとHIFはヘテロダイマー(2つの異なるものがくっついて1つの物を作っている)だということがわかりました。
1つは酸素感受性の部分(HIF-1aと名付けられます)、もう1つはARNTと言われる構造的な因子。
![]()
HIF-1aが低酸素応答に重要だとされて、HIF-1aをもっと詳しく調べることにしました。
HIF-1aの量を制御しているのは何か?
ラトクリフらはHIF-1aは何によって制御されているのかを調べました。
すると、HIF-1aの量はエリスロポエチンのように遺伝子の転写によって制御されているのではなく、タンパク質の安定性や合成・分解によって制御されていると言うことがわかってきました。
(遺伝子レベルではなくてタンパクレベルで調節されていたのです!)
その後多くのグループによって、HIF-1aはユビキチン-プロテアソーム経路を通って分解され、その分解は酸素依存的に起こることがわかってきました。
酸素依存的にユビキチンがつけられるHIF-1a特異的な構造領域も特定されました。
![]()
HIF-1aに似た分子もある
HIF-1aと非常によく似た分子があると言うことが、1997年に4つのグループから別々に報告されました。(Yoshiaki Fujii-Kuriyama, Werner Risau, Christopher Bradfield, and Steven McKnight, all in
1997)
![]()
このHIF-1aに似た分子をEPAS1(Endothelial PAS domain-containing protein 1)と名付けられました。
EPAS1の遺伝子はHIF-1a遺伝子と非常によく似ていて(ホモロジーが高い)、ARNTと結合してヘテロダイマーを形成することもわかりました。
EPAS1はHIF-1aの低酸素応答の機能を共有しているのですが、HIF-1aとの大きな違いは、
HIF-1a遺伝子欠損マウスは致死性ですが、EPAS1遺伝子欠損遺伝子は表現系が多様である
と言うことです。
![]()
EPAS1の主な役割は、赤血球を作る初期段階での制御が挙げられます。
EPAS1はこのあと、HIF-1aの低酸素応答の研究に比較と言う上で重要な役割を果たします。
酸素による活性化シグナル経路(酸素の濃度変化に応答して動くシグナル経路)は、少なくとも300の遺伝子によって制御されていて、非常に幅広い制御機構が存在していることがわかってきました。
![]()
HIFの発見でわかったこと〜まとめ〜
HIFの発見の原点はエリスロポエチンの発見でした。
これは人が高所に行くと分泌されるホルモンでしたね。
その当時(1880年代)、生体内の酸素濃度が変化すると言うのは「高所」に行くことくらいしか考えられませんでした。
しかし、100年経った1970年〜1980年に様々な研究がなされて、
- 動物の組織内の酸素レベルは通常の生理活動でも起こりうる
- 時間的空間的に常に変化する
- ガンや細菌感染など病気になる過程でも起こる
ということがわかってきました。
![]()
局所的で一時的な酸素濃度の変化に対する応答は、細胞や組織の維持に重要な応答反応だと認識されはじめました。
HIFの発見でどんなことがわかってきたのかをまとめます。
- 低酸素に対する応答(エリスロポエチンの分泌など)は遺伝子転写で制御されている
- この遺伝子転写を制御しているHIF-1aは生命が生きていくのに不可欠である
- その遺伝子転写制御はタンパク質の分解合成(代謝)で制御されている
- タンパク質分解合成は何らかの酸素応答で動いている
- 低酸素濃度に対する応答の結果、発生や再生、血管新生などの表現系として現れる
HIFに関する1970年代〜1980年代の研究は、典型的なタンパク質解析研究のパターンでその当時様々な分野で行われていた手法が大いに取り入れられています。
今や教科書に載っているような、常識となりつつあることも先人が一つ一つ試行錯誤して積み重ねてきた結果だと思うと感慨深いですね。
この話の続きは次の記事でご紹介します。
最後までお読みいただきありがとうございました。
















