
実験のそれぞれのステップはどんな意味があるのか知っておくことは、失敗した時のトラブルシューティングの役に立ちますよね。
研究室で日常茶飯事に行われる「免疫染色」。(ここでは免疫組織化学染色や免疫細胞化学染色を指しています)
結構細かなステップがあって、どんな意味があるのかよくわからないでなんとなーくやっていたりすることもあるのではないでしょうか。
『免疫染色の基礎知識』シリーズでは、免疫染色のそれぞれのステップにどんな意味があるのか?をまとめていきます。
今回は、「ブロッキング」についてです。
よく、二次抗体のホスト由来の血清を使うと言われますがなぜか知っていますか?
血清以外にも選択肢があることを知っておけば、実験の幅が広がるかもしれません。
基本的な免疫染色のステップは下記の通りです。

免疫染色と言っても免疫組織化学染色と免疫細胞化学染色があります。二つの違いはこちらの記事にまとめています。
酵素抗体染色・蛍光抗体染色、直接法・間接法の違いはこちらの記事にまとめています。
サンプルの準備〜透過処理まではこちらの記事にまとめています。
免疫染色のブロッキングってなんのためにするの?
ブロッキングは、"blocking"で英語辞書的には「阻止する」という意味です。
何を「阻止する」のでしょう。
免疫染色は抗原抗体反応を使います。
抗体は抗原の「エピトープ」を認識して結合します。
「エピトープ」は大抵、タンパク質の表面にある5個程度の糖鎖、5〜8アミノ酸残基の配列で構成され、その配列や立体構造が認識されます。
生物の反応には100%はなく、似たような配列や立体構造を持つものに結合してしまう、「非特異的な反応」が起こることもあるのです。
実験で抗原抗体反応を使う場合にこの「非特異的な反応」は、バックグラウンドの上昇、誤って陽性と判断してしまう可能性を高めてしまいます。
特に間接法で使われる二次抗体は、「抗体」を抗原として作製されます。
どの動物種でも似ており、とても大きなタンパク質を標的とするため、「非特異的な反応」が起こりやすくなりバックグランド上昇の原因となります。
「ブロッキング」の作業をすることによって、「非特異的な反応」を最小限に抑えて検出感度を高めているのです。
一般的にブロッキングに使う試薬は大きく分けて3つあります。
- 正常動物血清
- BSA (Bovine Serum Albumin)
- スキムミルク
この3つの違いを次の項で詳しく見ていきましょう。
ブロッキング剤による違い
1. 正常動物血清
最も一般的に使われるのが、正常動物血清です。
間接法の場合は、ブロッキング剤の第一候補として二次抗体ホスト動物と同種動物の正常血清が挙げられます。
例えば、標識二次抗体がヤギ由来のもの(例:抗ヤギ抗マウスIgG抗体)であればヤギの血清を使います。
※直接法を使う場合には一次抗体のホスト動物と同種動物の正常血清を使います。
正常血清を使う大きな理由は、血清の中にはたくさんの「抗体」が含まれているからです。
免疫染色に使うのも「抗体」、ブロッキングに使うのも「抗体」です。
ブロッキングに「抗体」を使うと反応を阻害してしまうのではないか?と思ってしまいますよね。
「抗体」には、
- タンパク質表面に存在するエピトープに結合する
- 自分の身体の中で作られたタンパク質に対する抗体(自己抗体)はない
という特徴があります。
この特徴を利用することで、「抗体」を使ってブロッキングをします。
抗体はホスト動物(宿主)に抗原を投与して、免疫反応を起こして作製されます。

正常動物血清の選択でタブーとされるのは一次抗体のホスト動物と同種の血清を用いることです。
自己抗体がないのであれば、一次抗体の非特異的な結合を抑えられそうですが、なぜ一次抗体のホスト動物と同種の血清を使ってはいけないのでしょう?

一次抗体ホストの血清を使うと、二次抗体が血清に含まれている別の抗体を認識して結合してしまうため、どれが抗原A由来のシグナルかわからなくなってしまいます。
では、二次抗体ホスト動物と同種の正常血清を使った場合はどうなるか少し考えてみます。
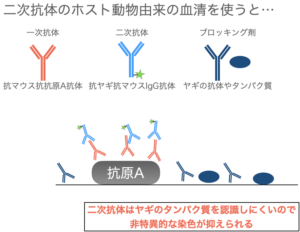
ここで注意しておきたいのが、二次抗体ホスト動物と同種の正常血清を使ったとしても、二次抗体の非特異的な結合によるバックグランドの軽減はできるかもしれませんが一次抗体の非特異的反応を抑えられるわけではありません。(生物の反応に100%はありません)
その場合は一次抗体のホスト動物以外の血清(ウシ血清など)や、BSAやスキムミルクなどの他のブロッキング剤の使用を考えましょう。
2. BSA(Bovine Serum Albumin)
動物の正常血清の代替として一般的に使用されます。
BSAは約66 kDaの単一のタンパク質(アルブミン)しか含まれません。
そのため、抗体と反応する可能性が低く、リン酸化タンパク質の検出によく使われます。
バックグラウンドを下げる効果はあまりありません。
3. スキムミルク
ウェスタンブロッティングのブロッキング剤としてよく使われます。
ブロッキング剤として最初にスキムミルクを使った人のお話がcytiviaの生化夜話 第35回に載っています。
最初は「安くて、タンパク質が豊富に含まれているもの」として、目に止まったのがスキムミルクだったそうです。
一般的に1〜5%の濃度に調製して使われます。
小さなタンパク質の分子が豊富に含まれるため、高いブロッキング効果が得られ、バックグラウンドを下げる(抗体の非特異的結合を抑える)効果があります。
しかし、低濃度のタンパク質を検出したい時に検出感度が低くなってしまう(オーバーブロッキング)ことがあるので注意が必要です。
また、リン酸化タンパク質を多く含むので、タンパク質のリン酸化を検出したい場合には注意が必要です。(使用直前に使用すれば影響はないとする人もいます)
ミルクにはビオチンも入っているため入っているため、アビジン-ビオチンの反応を使う酵素抗体法では使用しません。
三つのブロッキング剤についてまとめておきましょう。

参考文献
サイエンス系お役立ちメディアM-hub 【研究ツールとしての抗体技術】抗原とエピトープ (2022年3月6日参照)
Sino Biological ウェスタンブロット用の膜ブロッキング (2022年3月10日参照)
nacalai tesque 【コラム】免疫染色用の細胞サンプルの準備(透過処理・ブロッキング編)(2022年3月10日参照)














