
一言で「めんせん(免染)」と言っても、免疫組織化学染色(IHC:Immunohistochemistry)と免疫細胞化学染色(ICC:Immunocytochemistry)があります。
どちらも、「抗体の特異性使って抗原を検出、抗原の局在を観察する手法」ですが...どちらがどのように違うのか説明できますか?
この記事では、IHCとICCがどのように違うのか実験手順も含めてまとめていきます。
免疫組織化学染色(IHC)は組織内のタンパク質の局在を観察する
まさに名前の通りですが、Immunohistochemistryの"histo"はギリシャ語で「組織」を表す「ἱστός: histos)から来ています。(出典:Wikipedia)
組織内に標的のタンパク質がどのように局在しているか、抗原抗体反応を使って標識し、顕微鏡で観察します。
組織を観察するため、パラフィン切片や凍結切片を用いて染色します。
大まかなIHCの流れは以下の通りです。

※上図での「POD」はペルオキシダーゼの略です
パラフィン切片か凍結切片か
パラフィン切片を用いるか、凍結切片を用いるかで染色の工程がかなり異なるのもIHCの特徴でもあります。
パラフィン切片を使う場合は、「脱パラ」と言う操作が必要となります。
パラフィン切片は一般的にはタンパク質の染色には向かないとされているので、IHCには凍結切片が用いられることが多いです。
IHCは切片を用いた染色なので、スライドガラス状で染色作業を行います。
抗体液などが流れないように、切片の周りをハップペンを使って撥水性の枠を作ります。
抗体の節約や均一に反応させるのに有効だとされています。
抗原賦活化処理とは?
ICCと大きく異なる点としては、抗原賦活化処理を行う場合があることです。
「抗原賦活化処理」の、「賦活化」とは活性化する、活力を与えると言う意味で英語ではactivationに相当する意味を持ちます。(不活化と全く逆の意味なので気をつけましょう)
「抗原賦活化処理」は切片を作製する過程で組織中の抗原が変性し抗体が結合できる部位(エピトープ)を露出させる過程のことです。
大きく分けて熱処理と酵素処理があり、酵素処理はProteinase Kやペプシンを反応させるので組織形態が崩れやすくかなりの注意が必要となります。
IHCは蛍光染色や色素染色が行われる
IHCでは、標識酵素の反応を使った発色基質(DABなど)による色素染色や蛍光色素を用いた蛍光染色が一般的に行われています。
色素染色の中でも、標識酵素としてペルオキシダーゼ(POD)を用いる場合は、内在性のペルオキシダーゼ(POD)を不活化する必要があります。
過酸化水素水を用いて不活化させる方法が一般的に行われています。
蛍光染色はAlexa Fluor®︎色素などの蛍光色素を標識した二次抗体を使って、蛍光顕微鏡で検出します。
この一次抗体と標識が付いた二次抗体を反応させて検出させる方法を間接法と呼びます。
それぞれの染色方法に関しては下記の記事にまとめています。

対比染色をして封入する
目的のタンパク質とは異なる色となるように、細胞内のコンパートメントを特異的に染色することを「対比染色(Counterstains)」と言います。
蛍光色素を用いた対比染色としては、DAPIやHoechstを用いた核を青く染色する方法が一般的に行われます。
他にも、Phalloidin(ファロイジン)用いて、細胞内のアクチンを染色することで細胞骨格を標識する場合もあります。
サンプルの乾燥や退色を防ぐため、封入剤を用いてカバーガラスで封入します。
免疫細胞化学染色(ICC)は培養細胞内のタンパク質の局在を観察する
こちらも名前の通りImmunocytochemistryの"cyto"は英語で「細胞」と言う意味の接頭辞で元々は古代ギリシャ語の「入れ物」を意味する「κύτος」から来ていると言われています。
細胞内に目的のタンパク質がどのように局在しているのかを観察する方法です。
接着性の細胞を使って、ガラスボトムディッシュを用いるのが一般的です。
大まかな流れは下記の通りです。(一般的に使われる間接法の流れです)
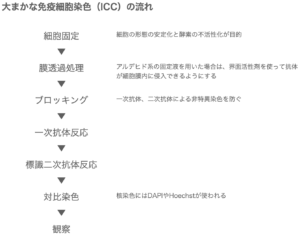
細胞の固定法を選択する
固定液には大きく分けて、ホルムアルデヒドなどのアルデヒド、アセトンなどの有機溶媒に分けられます。
それぞれの特徴をまとめています。

ICCをする場合には膜透過処理が必要
ICCとIHCの大きな違いは、切片を使うか、培養細胞を使うかです。
切片を使う場合、抗原が切片表面に露出しているため、抗体が抗原へダイレクトに届きます。
培養細胞を使う場合、細胞は細胞膜に覆われているためアルデヒドを用いて固定しただけでは抗体が抗原のある細胞内に侵入することはできません。
そこで、低濃度かつ非変性界面活性剤を使って細胞膜の脂質二重層構造をゆるめることで細胞内に抗体が入りやすいようにします。
よく「細胞質に穴を開ける」と表現されます。
(有機溶媒を用いる場合には膜透過処理は不要)
ICCは主に蛍光染色が行われる
ICCはIHCと異なり、多くの場合で蛍光染色が行われます。(色素染色が全くないと言うわけではありません)
蛍光染色でもAlexa Fluor®︎色素を標識した二次抗体を使った間接法による検出が主に行われています。
各染色法に関しては下記の記事にまとめています。

二次抗体反応のあと、IHCと同様にDAPIやHoechstを使った対比染色をして観察します。
免疫組織染色(IHC)と免疫細胞染色(ICC)の違い まとめ
IHCとICCの違いをまとめます
- IHC、ICCどちらもタンパク質の局在を観察する手法
- IHCはパラフィン切片や凍結切片、ICCは培養細胞を用いる
- IHCは色素染色も良く用いられるが、ICCは一般的には蛍光染色で検出する
- IHCは扱う切片の種類、検出法によりさまざまなプロトコルがある
- ICCは膜透過処理をすると言う点でIHCと大きく異なる
参考文献
ThermoFisher SCIENTIFIC 免疫組織化学(IHC)の対比染色(Counterstains)
















