
生命科学系の学生さんだったら研究室で、「Cre-loxPシステム」という言葉を一度は耳にしたことがあるかもしれません。
ランダムに外来遺伝子を導入する「遺伝子組換えマウス・トランスジェニックマウス」では、目的の遺伝子を過剰に発現させるか、壊すか、の100か0の調節しかできませんでした。
受精卵の時に遺伝子に変異があるので、変異を入れた遺伝子が成長に重要な遺伝子だったら、赤ちゃんは生まれてこられず(胎生致死)、生まれてきてからどんな遺伝子なのか解析ができませんでした。
近年では、遺伝子を発現させない時期を調整できるコンディショナルノックアウトが一般的になってきています。
研究室のみんなが当たり前のように「コンディショナル」「コンディショナル」と言っても、初めて研究室に配属された学生さんだったら頭の中は「??」でいっぱいになってしまうのではないでしょうか。
「コンディショナルノックアウト」=Cre-loxPシステムを使っていると言っても過言ではないので、今回はCre-loxPシステムについて簡単にまとめておきます。
Cre-loxPシステムが遺伝子組換え動物に使われるようになった背景
従来の「遺伝子組換え法」だと目的遺伝子を過剰に発現させるか、壊すかの調節しかできませんでした。
遺伝子を壊す(ノックアウト)場合、生体維持に重要な遺伝子ほど胎生致死(生まれてこられない、正常に発生段階を踏めない)になってしまいます。
「コンディショナルノックアウト」の「コンディショナル(conditional)」(条件付き)の意味を考えてみましょう。
どのような条件をつけるかというと、「特定の組織(ある特定の遺伝子が発現している細胞)に、特定の時期に」という条件をつけます。
この組織(細胞)特異的、時期特異的に遺伝子の発現を制御するために、Cre-loxPシステムが用いられます。
トランスジェニックマウスに関してはこちらの記事をご覧ください。
Cre-loxPシステムの発見
Cre-loxPシステムはもともと1981年に見出された、バクテリオファージP1が持つ感染した宿主細胞に自分のDNAを取り込ませるシステムでした。
1987年にBrian Sauerにより、真核生物である酵母を用いて、ファージのシステムであるCre-loxPシステムが真核細胞の核内でも働くことが報告されました。
この報告により、「コンディショナルノックアウト」への応用が盛んに行われるようになります。
Cre-loxPシステムとは?
前置きが長くなりましたが、ここからは「Cre-loxPシステム」とは具体的にどんなものか?見ていきましょう。
「Cre-loxPシステム」のCreはDNA組換え酵素で、loxPというのは34bpの遺伝子配列のことです。
Creリコンビナーゼ(DNA組換え酵素)はloxP配列を認識して、loxP配列に囲まれた部分を部位特異的組換えを引き起こして切り出してしまいます。
loxP配列は方向性を決める13 bpの逆位反復配列の間に8 bpのスペーサーがある合計34 bpの配列です。
逆位反復配列にCre リコンビナーゼに結合します。
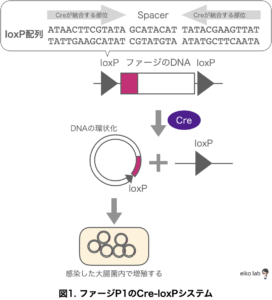
このバクテリオファージP1が持っていた「Cre-loxPシステム」を遺伝子組換え技術に応用するにはどうしたら良いのでしょう?
Cre-loxPシステムを使って組織・細胞特異的ノックアウトマウスを作る
まずは、組織・細胞特異的に遺伝子発現を抑制するマウスの作製について見ていきましょう。
手順としては、
調べたい細胞特異的に働いているプロモーターの下流にCreを入れておく(Creマウス)
もしくは細胞特異的に発現している遺伝子の下流にCreが発現するような仕掛けにしておく
ノックアウトしたい遺伝子をloxP配列で囲んでおく(LoxPマウス)(※floxedマウスとも言われます)
CreマウスとLoxPマウスを掛け合わせると、Creを部位特異的に発現する標的遺伝子をLoxP配列で挟まれたマウスが生まれます。
Creが発現する標的組織ではLoxP配列で囲まれた標的遺伝子は切り出されて発現されなくなる。
Creが発現しない組織では通常通りに遺伝子が発現される。
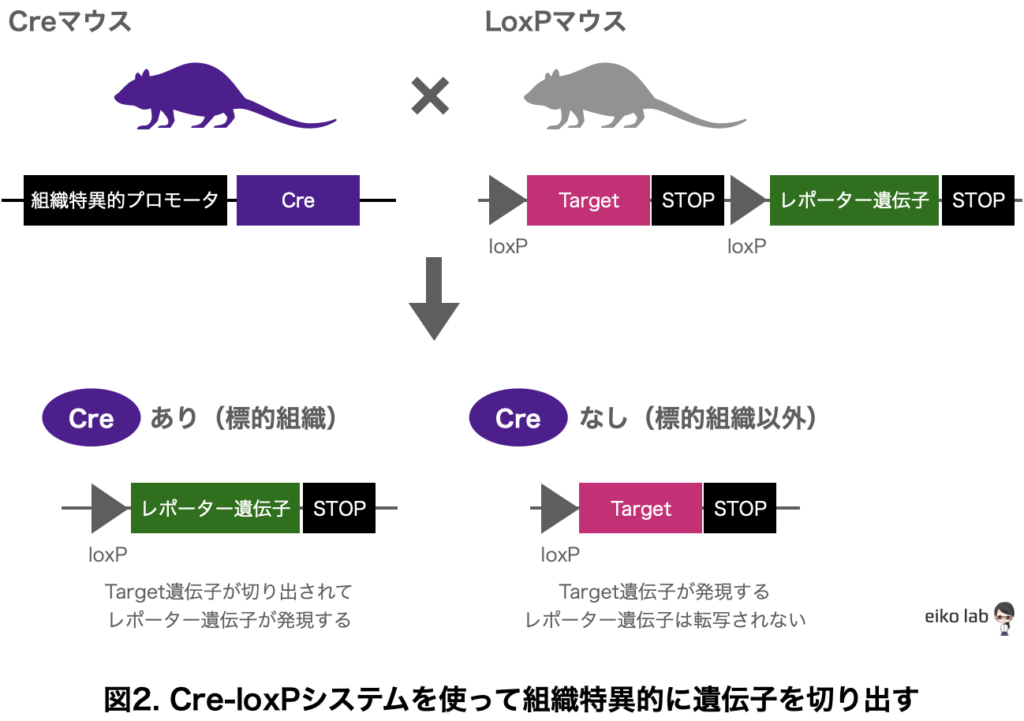
このシステムを使えば、細胞特異的に遺伝子の発現を抑制できるということなのです。
floxedマウスに関してはこちらの記事をご覧ください

Cre-loxPシステムを使って時期特異的ノックアウトマウスを作る
次に時期特異的に遺伝子発現を抑制するマウスの作製について見ていきます。
Creタンパク質にちょっとした仕掛けを施しておきます。
それが、Creタンパク質とエストロゲン受容体(ER)を結合させます(CreER)。
なぜエストロゲン受容体と結合させると、時期特異的に遺伝子発現を抑制することができるのでしょうか?
エストロゲン受容体はエストロゲンと結合していない時には細胞質に局在し、エストロゲンが結合すると核内に移行する性質があります。
エストロゲンの誘導体であるタモキシフェンを注入すると、タモキシフェン(Tam)とCreERが結合すると核の中に入って標的遺伝子の転写活性化をします。
核内に結合した、CreERがLoxP配列で囲まれた標的遺伝子を切り出して遺伝子発現が抑制されるのです。
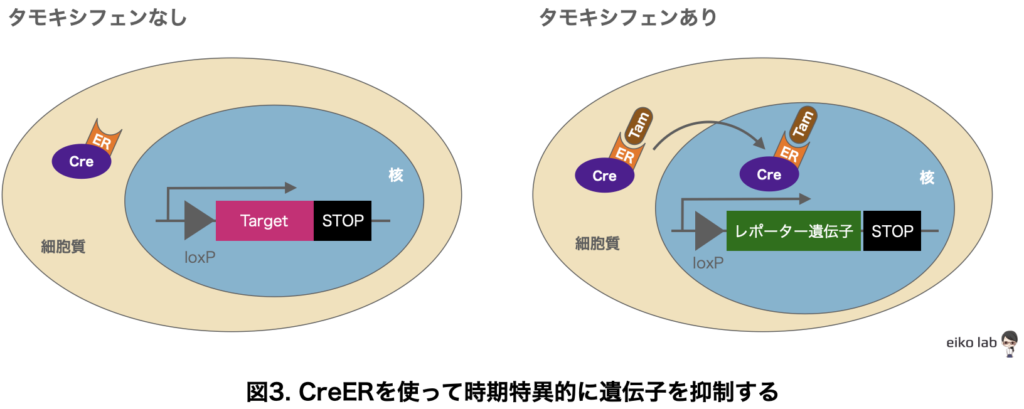
タモキシフェンを打てば、遺伝子がノックダウンされるので時期が調節できるというわけなんですね。
最初に報告されたCreERは内在性のエストロゲンに反応してしまい、うまく時期を制御できないという問題がありました。
そこでChambonらのグループがERに点変異をいくつか導入し、内在性のエストロゲンには反応せず、タモキシフェンに反応する変異体を作製(ERT2)しました。
現在は、CreERT2が主流となっています。
Cre-loxPシステムとは? まとめ
最後に、Cre-loxPシステムについてまとめます。
- Cre-loxPシステムは「コンディショナルノックアウトマウス」作製によく用いられる
- 「コンディショナル」とは組織特異的・時期特異的に遺伝子発現を制御できるということである
- Cre-loxPシステムはもともとファージP1が持つシステムだった
- エストロゲン受容体とCreを結合させることで時期特異的に遺伝子発現を制御できるようになった
- 最近はタモキシフェンを特異的に認識するERT2を使用するのが主流になっている














