
実験のそれぞれのステップはどんな意味があるのか知っておくことは、失敗した時のトラブルシューティングの役に立ちます。
研究室で日常茶飯事に行われる「免疫染色」。(ここでは免疫組織化学染色や免疫細胞化学染色を指しています)
結構細かなステップがあって、どんな意味があるのかよくわからないでなんとなーくやっていたりすることもあるのではないでしょうか。
『免疫染色の基礎知識』シリーズでは、免疫染色のそれぞれのステップにどんな意味があるのか?をまとめていきます。
基本的な免疫染色のステップは下記の通りです。

この記事では、ピンクの枠で囲ったサンプルの準備から透過処理までのステップの意味についてまとめています。
免疫染色と言っても免疫組織化学染色と免疫細胞化学染色があります。二つの違いはこちらの記事にまとめています。
酵素抗体染色・蛍光抗体染色、直接法・間接法の違いはこちらの記事にまとめています。
準備の準備:用意する細胞について
免疫組織化学染色の場合は生体の組織を準備すれば大丈夫です。
細胞を扱って細胞内の構造や、タンパク質の局在を明瞭に可視化するためにはどうすれば良いのでしょう?
細胞は密度が大事
培養細胞は、培養しているときもそうですが「密度」が大事です。
免疫染色に向くのは60%〜80%コンフルエント。
細胞が重なり合わないが、隣接している細胞が強拡でも見えるくらいの密度が良いです。
細胞が重なり合ってしまうと、染色像も重なり合ってしまい細胞構造が不明瞭になってしまいます。
接着細胞の場合
免疫染色で使う細胞は接着性の細胞を使うことが多いかと思います。
染色を行う場合はプレートディッシュではなく、ガラスボトムディッシュなどを使ってガラスの表面に細胞を接着させて検出するのが一般的です。
なぜプラスチック製のディッシュではなくガラスの上の方が良いのでしょうか?
1つ目は、プラスチックは自家蛍光が強くバックグランドが高くなる
2つ目は、プラスチックの方がガラスに比べて屈折率が高い
3つ目は、ガラスは厚さが0.1 mm程度と薄いのに対しプラスチックは厚さ約1 mm
が挙げられます。
この3つの理由から、蛍光抗体法を用いる場合は高い倍率でも鮮明な染色像が得られるガラスに接着させた細胞を使います。
細胞は市販されているガラスボトムディッシュか、培養シャーレにカバーガラスを入れてたものに接着させます。
培養プレートにカバーガラスを入れて接着させる方法
- カバーガラスはオートクレーブorクリーンベンチ内のUV照射で滅菌
- クリーンベンチ内でエタノール洗浄
ガスバーナーで炙って乾燥させて培養プレートに入れる - 必要であれば足場となる細胞外基質をコーティング
(一般的にPLLが使われるが、細胞種によってコラーゲン、ラミニン、ゼラチン、フィブロネクチンを使い分ける) - 細胞を播種する
組織を使う場合は凍結切片またはパラフィン切片でサンプルを準備します。
凍結切片とパラフィン切片の違いはこちら。
組織・細胞形態を維持する「固定」
そもそも「固定」とはなんのために行うのでしょう?
- 組織・細胞の形態、構造を維持する
- タンパク質分解酵素による細胞の自己融解を防ぐ
- サンプルの腐敗を防ぐ
の3つの目的のために行われます。
「固定」のポイントは、①サンプルを採取したら(培養液を除いたら)すぐ行う、②固定しなすぎ・しすぎに注意する、です。
②固定しなすぎ・しすぎに注意するは、固定が不十分だと標的タンパク質が壊れてしまい、固定しすぎてしまうと抗原性が弱くなってしまうことがあります。
「固定」の時に使われる薬剤としては大きく、アルデヒド系と有機溶媒系の2種類に分けられます。
アルデヒド系固定液
ホルムアルデヒド系固定液に分類されるのが、ホルマリン・ホルムアルデヒド(パラホルムアルデヒド: PFA)です。
初めて染色するタンパク質の場合は、まずアルデヒド系で固定してみましょう。
タンパク質同士のアミノ基(-NH2)を介して分子架橋を形成し、タンパク質同士をネットワークのように繋げて固定します。
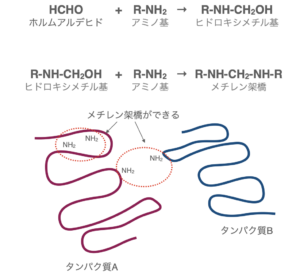
最も一般的に用いられる固定法で、膜タンパク質の染色に向いています。
主に10%ホルマリン、4%PFAが使われます。
10%ホルマリンは、飽和ホルムアルデヒド(37%w/v)でアルデヒド同士が重合しないようにメタノールが入っています。
4%PFAは、重合したホルムアルデヒド粉末をPBSに溶解したもの(メタノールなどは入っていない)
※市販の4% PFAには酸化してギ酸が生じるのを防ぐためにメタノールが入っています
脂質の多い脳組織の膜タンパク質の検出には都度調製した4%PFAを使います。
一般的には4%PFAや10%ホルマリン固定は室温で10〜20分で行われます。
※グルタルアルデヒドというアルデヒド基を2つ持つ強力な固定剤を電顕の場合に使うことがあります。(自家蛍光が増強されるという難点もあります)
有機溶媒系固定液
有機溶媒系固定液に分離されるのは、メタノール、アセトン、ピクリン酸などです。
強力な脱水作用により、細胞内のタンパク質沈降を引き起こします。
脱水作用があるため、組織を収縮させてしまったり、脂質は取り除かれてしまい、電顕用のサンプル調製には用いられません。
蛍光タンパク質も変性させるので、過剰発現したタンパク質検出にも不向き。
細胞膜が壊れるので、透過処理が要らないので時間の短縮になります。
アセトン固定はメタノールに比べて穏やかなので、メタノールと1:1で混合して使用する場合もあります。
一般的には-20℃にした冷メタノールで4℃で10〜20分固定します。
場合によっては必要ではない「透過処理」
「透過処理」は、抗体が細胞膜を通過して細胞内に入れるようにするために行います。
抗体は分子として大きすぎるので、通常の状態の細胞では細胞膜を通過できないため、細胞内のタンパク質を検出したい場合は透過処理が必要です。
「透過処理」には界面活性剤が使われ、最も一般的に用いられるのは非イオン製のTritonX-100です。
TritonX-100は0.1〜0.4%で使用し、室温で10〜15分で処理します。
有機溶媒系で固定したサンプルや、細胞膜表面のタンパク質を検出した場合には透過処理は必要ありません。
免疫染色の基礎知識〜準備から透過処理まで まとめ
この記事の内容をまとめます。
- 染色で細胞を使う場合は細胞密度は60〜80%程度が良い
- 細胞染色ではガラスボトムディッシュやカバーガラスの上に細胞を播種する
(細胞種によってコート剤を検討する) - 固定方法は大きく分けてアルデヒド系と有機溶媒系がある
最初はアルデヒド系で固定してみてうまくいかなかったら有機溶媒系を検討するのが良い - 透過処理は必要がない場合もある
参考文献
組織染色における固定化まとめ|知っておきたい!タンパク質実験あれこれ 第18回:Thermo Fisher SCIENTIFIC
【コラム】免疫染色用の細胞サンプルの準備(固定編):ナカライテスク
【コラム】免疫染色用の細胞サンプルの準備(透過処理・ブロッキング編):ナカライテスク














