
生命科学系なら必ずと言って良いほどどこの研究室でも行われているアガロース電気泳動。
あなたはどれくらい説明できますか?
特に核酸を扱う場合には毎日ゲルを作っているという人も多いのではないでしょうか?
研究室では常識と化している「アガロース電気泳動」ですが、その原理から様々な試薬の使い分けまでまとめておきましょう。
核酸の分離には二種類ある
一般的にDNAなどの核酸を分離する方法は、「アガロースゲル電気泳動」と「ポリアクリルアミドゲル電気泳動」が使われます。
どちらも「分子ふるい効果」を利用したもので、網目状の構造をもったゲルの中にDNAを通すことで大きさごとに分離することができます。
DNAは分子の大きさに比例した電荷(リン酸の負電荷)を持っていて、電荷をかけることで陰極から陽極に移動します。
電気泳動の速度はDNAの大きさや形状で決まることがわかっています(Helling et al., 1974)。
では、「アガロースゲル電気泳動」と「ポリアクリルアミドゲル電気泳動」の使い分けをもう少し見てみましょう。
「アガロースゲル電気泳動」でできること
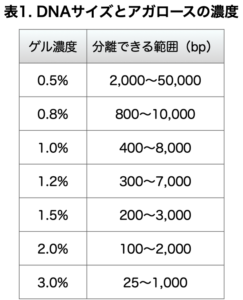
分子の目が大きいので数百〜数万塩基のDNA断片の検出に向いているとされています。
アガロースの濃度を変えることで、検出したい範囲の解像度を上げることができます。
一般的に短い断片(数百塩基程度)の場合は2~3%、長い断片(数万塩基)の場合は0.3~0.8%の濃度で使用します。
(検出したいDNAのサイズとアガロース濃度の関係は後述します)
「ポリアクリルアミドゲル電気泳動」でできること
ポリアクリルアミドゲルはアガロースゲルに比べて網目が細かいので、より短いDNA断片(数百塩基以下)の検出に向いています。
特に、塩基配列決定によく使われていました。
塩基配列決定時には一本鎖のDNA断片を泳動するため、二次構造(立体構造)の形成を防ぐために6Mの尿素を加えた変性ゲルが使われていました。
「ポリアクリルアミドゲル電気泳動」が使われていた、塩基配列決定(サンガー法)についてはこちらの記事にまとめています。

今回は、研究室でもっとも一般的に行われている「アガロースゲル電気泳動」についてさらに深掘りしていきたいと思います。
アガロースゲル電気泳動の手順
「アガロースゲル電気泳動」の手順の概要についてまとめていきましょう。
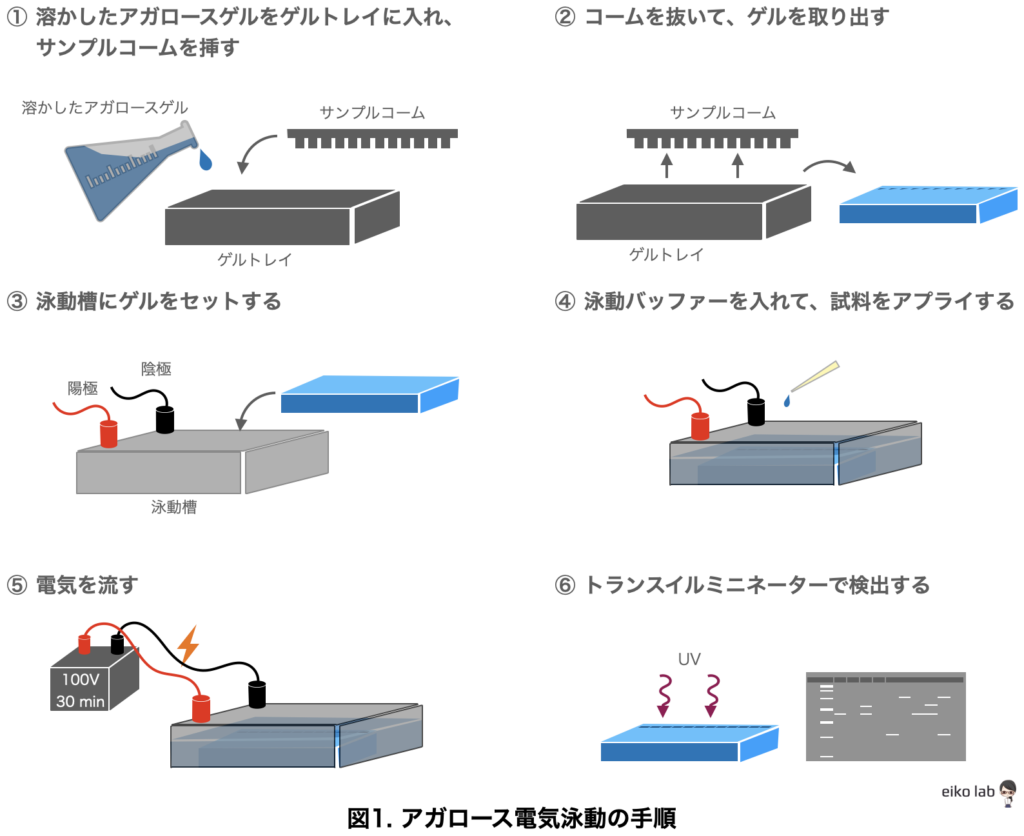
- 溶かしたアガロースをゲルトレイに入れてサンプルコームを挿す(室温で30分〜1時間)
※アガロースは泳動バッファーに入れて、電子レンジを使って溶かす(水に溶かさないように注意しましょう)
※突沸を防ぐために、頻繁に電子レンジから取り出して混ぜておくと良い
※上にラップなどを被せて乾燥を防ぐ - コームを抜いてゲルを取り出す
※コームは真っ直ぐ上に引き抜く - ゲルを泳動槽にセットする
※ウェルの穴が空いている方を陰極側にする - 泳動槽に泳動バッファーを入れ、試料をウェルに入れる(アプライ)
※試料をアプライする時には、ピペットマンと反対側の手を支えとして使うと安定する
※適切なアプライ量は後述する - 電気を流す
Mupidのミニゲルサイズ(ゲルの長さが6 cm程度)で、100V 30分 - 泳動後、トランスミッターを使ってバンドを検出する
※検出試薬の種類については後述する
バンドを検出したのち、目的のDNA断片を切り出してさらに実験を継続することが可能です。
アガロースゲル電気泳動後の切り出し回収に関しては、こちらの記事にまとめています。

DNAのサイズとアガロースの濃度との関係
DNAの長さアガロースの濃度の関係を表にまとめます。
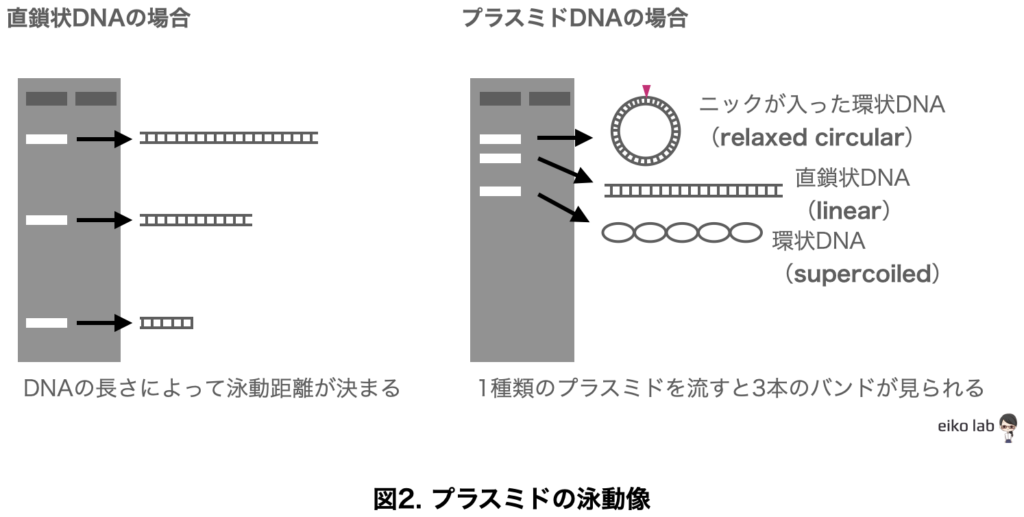
プラスミドを泳動した場合
直鎖状のDNAを泳動した場合は、短いDNA断片ほど流れる距離が長く、長いDNA断片ほど流れる距離が短くなります。
しかし、環状DNA(プラスミド)の場合はどうなるでしょう。
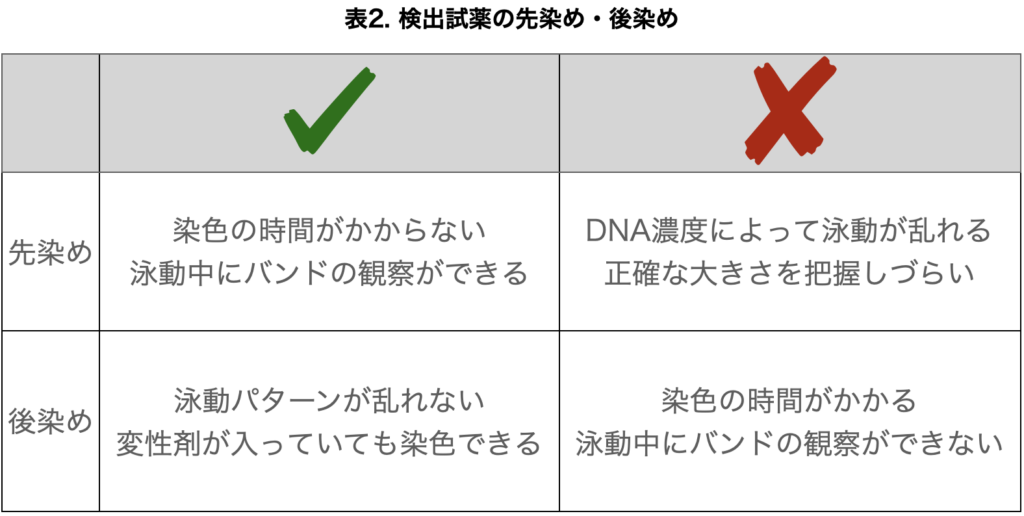
検出試薬はいつ入れたら良いのか?
検出試薬は、ゲルを作るときに入れたほうが良いのでしょうか?泳動後に染色した方が良いのでしょうか?
先染めと後染めのメリット・デメリットをまとめます。
泳動バッファーの使い分け
電気泳動用のバッファーにもTAE(Tris-Acetate EDTA)やTBE(Tris-Borate EDTA)、TPE(Tris-Phosphate EDTA)などの種類があります。
どのように違うのでしょう?
研究室で良く使われる、TAEバッファーとTBEバッファーの2つの違いを比べてみましょう。
TAEバッファー
TAEバッファーは名前の通り、Tris、酢酸、EDTAからなる緩衝液。
安価でTBEバッファーよりも10%ほど早く流れると言う特徴があります。
1500 bpを超えるような長い断片を検出するのに適しています。
また、TBEバッファーに比べて緩衝能が低く、劣化が早いため長時間の泳動を行うと陽極側のpHが酸性に傾いてオーバーヒートやサンプルの変性を引き起こしてしまうので注意が必要です。
TBEバッファー
TBEバッファーは、Tris、ホウ酸、EDTAからなる緩衝液でTAEに比べて高い緩衝能を持っています。
ゆっくり流れるため、短い断片の解像度が高いのが特徴です。
TBEバッファーは酵素反応を阻害するため、制限酵素、クローニング、PCRなどの電気泳動後に何かする場合は適さない場合もあるので使用には注意が必要です。
ホウ酸は廃液処理がめんどくさいと言う難点もあります。
TAEバッファーとTBEバッファーの違い まとめ
TAEバッファーとTBEバッファーの使い分けについて表にまとめておきます。

電気泳動をするときの適切なDNAアプライ量
学生の時に、「アガロースゲル DNA アプライ量」と言うキーワードで何回検索したことか...
あまりにも少ないと検出できないし、多すぎるとサチュレーションを起こしてしまうし...
なので電気泳動する時には適切なDNAアプライ量を知っておくことは大事なことです。
結論から言うと、検出試薬に依存します。
ここではラボで一般的に用いられるUV光またはブルーライトで励起して可視化する「エチジウムブロマイド(通称:エチブロ)」と「SYBR系色素」の染色で検出する場合で話を進めていきましょう。
エチジウムブロマイド
5 mm幅のウェルで約2 ng〜検出できると言われています。
しかし、500 ng以上アプライするとスメアになってきちんと見えなってしまいます。
数10 ng〜数100 ng程度のDNA量を目安に流すと良さそうですね。
エチジウムブロマイドは二本鎖DNAの間に入り込んで蛍光を発する試薬なので一本鎖の核酸染色には向きません。
毒性が高いため廃液処理が大変なので、毒性が低く特別な廃液処理を必要としない代替蛍光色素(SYBR系など)が使われることが多くなっています。
SYBR系色素
SYBR Goldは検出感度が非常に高く、約25 pg〜検出可能だと言われています。
一本鎖DNAやRNAを染色する際にもSYBR系の色素を用います。
アガロース電気泳動を説明できますか? まとめ
アガロース電気泳動についてまとめます。
- 数百〜数万塩基のDNAを検出するときは「アガロース電気泳動」を使う
- プラスミドを泳動する時には三本のバンドが見られる
- 検出したいDNA断片の長さによって泳動バッファーを使い分ける
- 使う検出試薬によって適切なアプライ量が異なる














